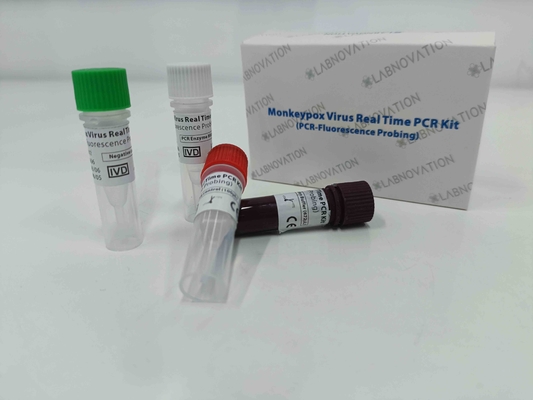
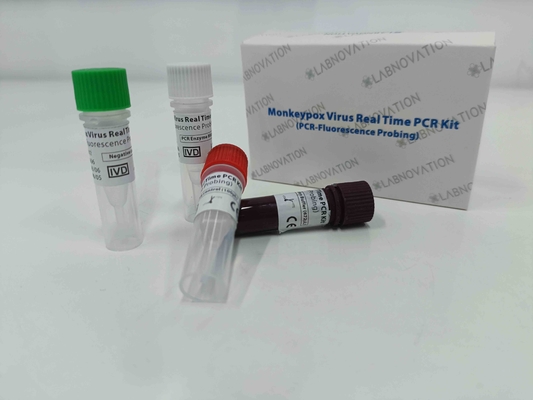
پیام بگذارید
ما به زودی با شما تماس خواهیم گرفت
 پیام شما باید بین 20 تا 3000 کاراکتر باشد!
پیام شما باید بین 20 تا 3000 کاراکتر باشد!
 لطفا ایمیل خود را چک کنید!
لطفا ایمیل خود را چک کنید!
ارسال
اطلاعات بیشتر ارتباط بهتر را تسهیل می کند.
آقای.
- آقای.
- خانم
خوب
با موفقیت ثبت شد!
ما به زودی با شما تماس خواهیم گرفت
خوب
پیام بگذارید
ما به زودی با شما تماس خواهیم گرفت
 پیام شما باید بین 20 تا 3000 کاراکتر باشد!
پیام شما باید بین 20 تا 3000 کاراکتر باشد!
 لطفا ایمیل خود را چک کنید!
لطفا ایمیل خود را چک کنید!
ارسال